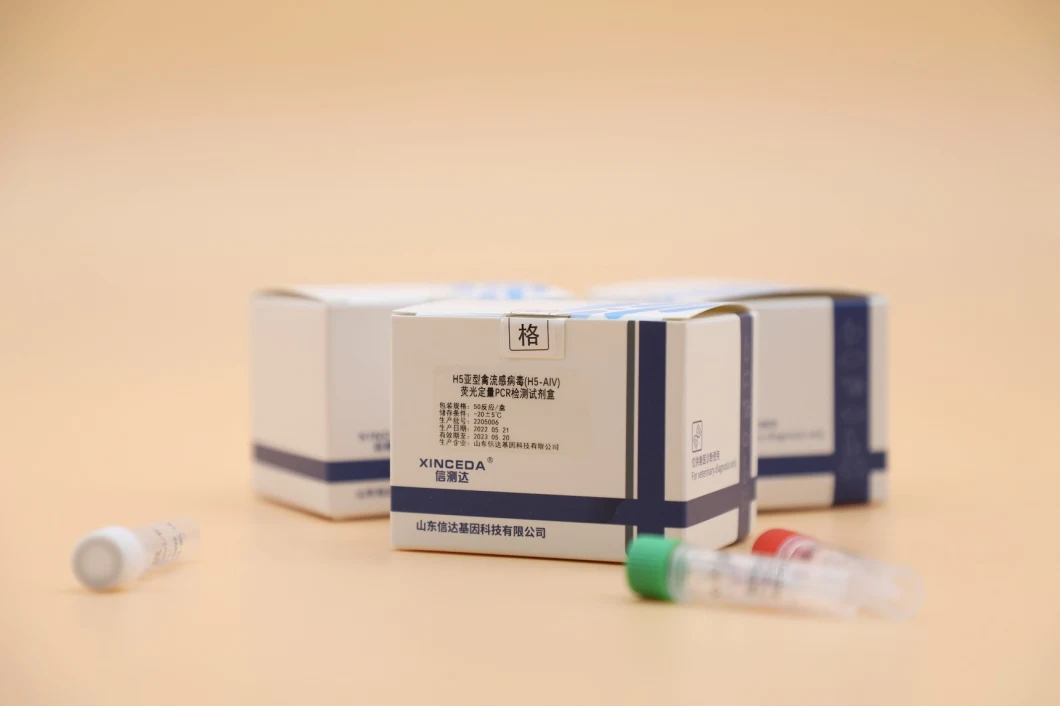
Kit de détection du virus de la grippe aviaire H5/H7/H9/Universal Subtype Rna (PCR-Fluorescence Probing)
Informations de base
| Modèle NON. | H5/H7/H9/PCR universelle |
| Taper | Trousse de détection |
| Seringue | N / A |
| Aiguille de prélèvement sanguin | Tuyau en plastique |
| Modèle de respiration | N / A |
| Méthode de contrôle de la machine d'anesthésie animale | N / A |
| Durée de conservation | 12 mois |
| Température | -20 |
| Congélation et décongélation | Moins de 3 fois |
| En vigueur | Tous les instruments PCR |
| BPF | 15074 |
| Forfait transport | Voie aérienne/voie maritime |
| spécification | 50 TROUSSES/BOÎTE |
| Marque déposée | CENDRE |
| Origine | Chine |
| Code SH | 3822001010 |
| Capacité de production | 50000boîte/an |
Description du produit
Kit de détection du virus de la grippe aviaire H5/H7/H9/ARN de sous-type universel (PCR-Fluorescence Probing)(Nom du produit) Kit de détection du virus de la grippe aviaire H5/H7/H9/ARN de sous-type universel (PCR-Fluorescence Probing)
(Paquet) 50 kits/boîte
(Indication) Le kit de détection du virus de la grippe aviaire H5/H7/H9/Universal RNA (PCR-Fluorescence Probing) est applicable pour détecter le virus de la grippe aviaire H5/H7/H9/Universal RNA dans un écouvillon de gorge aviaire, un écouvillon de cloaque, des tissus, du liquide allantoïdien d'embryon de poulet et une culture cellulaire. Les résultats des tests sont à des fins de recherche uniquement et non à des fins de diagnostic clinique.
(Principaux composants et contenu)
| Nom | spécification | Quantité |
| H5/H7/H9/Solution de réaction trivalente universelle | 1250µl/tube | 1 |
| H5/H7/H9/Contrôle positif universel | 250µl/tube | 1 |
| Contrôle négatif | 250µl/tube | 1 |
Stocké à -20 ± 5 ° C, Congélation et décongélation répétées ≤ 3 fois, la durée de conservation est de 12 mois.
(Modèle)
ABI 7500, ABI QuantStudio 5, CFX Connect, CFX Opus 96, LightCycler480, Gentiter 96E/96R, LineGene 9600 Plus et autres amplificateurs PCR quantitatifs fluorescents.
(Méthode d'essai)
- Extraction d'acide nucléique
- Amplification PCR
2.2 Ajouter 5 µl d'acide nucléique de contrôle négatif, de contrôle positif et d'échantillons dans les tubes de réaction PRC ci-dessus respectivement, centrifuger à 8 000 rpm pendant plusieurs secondes et les placer dans l'amplificateur PCR quantitatif fluorescent.
2.3 Les conditions de réaction sont fixées comme suit :
| Paramètres pertinents de l'amplificateur | |||
| Système | Volume total : 30 µl | ||
| Collecte de signaux | Grippe Aviaire H5/H7/H9/Universelle | Sous-type H5 - Le canal HEX recueille le signal de fluorescence | |
| Sous-type H7 - Le canal FAM recueille le signal de fluorescence | |||
| Sous-type H9 - Le canal Cy5 recueille le signal de fluorescence | |||
| Universel - Le canal ROX collecte le signal de fluorescence | |||
Conditions de réaction PCR | Organiser | Condition | Numéro de cycle |
| Transcription inversée | 55°C : 15 minutes | 1 | |
| Prédégénérescence | 95ºC : 30 secondes | 1 | |
PCR | 95ºC : 10 secondes | 40 | |
| 56ºC : 30 secondes (Réglé pour collecter le signal fluorescent à la fin de cette étape) | |||
(Interprétation des résultats)
- Détermination de l'efficacité du kit de test :
- Contrôle positif faible : valeur Ct des canaux FAM, HEX, Cy5 et ROX ≤ 32, courbe d'amplification avec une phase exponentielle évidente.
- Contrôle vierge : les canaux FAM, HEX, Cy5 et ROX n'ont pas de courbe d'amplification, ou la courbe d'amplification est droite ou légèrement oblique, pas de phase exponentielle significative et valeur Ct ≥ 38 ou pas de valeur Ct.
- Détermination des résultats :
| Jugement du résultat | Chaîne FAM | Canal HEX | Canal Cy5 | Canal ROX |
| Acide nucléique du sous-type H5 du virus de la grippe aviaire positif | - | + | - | + |
| Acide nucléique du sous-type H7 du virus de la grippe aviaire positif | + | - | - | + |
| Acide nucléique du sous-type H9 du virus de la grippe aviaire positif | - | - | + | + |
| Acide nucléique de sous-type H5/H7 du virus de la grippe aviaire positif | + | + | - | + |
| Acide nucléique de sous-type H5/H9 du virus de la grippe aviaire positif | - | + | + | + |
| Virus de la grippe aviaire H7/H9 sous-type nucléique positif | + | - | + | + |
| Virus de la grippe aviaire H5/H7/H9 sous-type nucléique positif | + | + | + | + |
| Acide nucléique faiblement pathogène du virus de l'influenza aviaire positif | - | - | - | + |
| Acide nucléique du virus de la grippe aviaire négatif | - | - | - | - |
- S'il existe une courbe d'amplification de phase de croissance logarithmique et une valeur Ct ≤ 36, elle est jugée comme +. S'il n'y a pas de courbe d'amplification ou de valeur Ct > 36, elle est jugée comme -. Les échantillons sont suspects lorsque 36 < valeur Ct <40, qui doit être retesté.
- Si les résultats de n'importe quel sous-type H5/H7/H9 sont + avec le canal ROX -, qui doit être retesté.
- La gestion du laboratoire doit être strictement conforme aux spécifications de gestion du laboratoire d'amplification génique par PCR. Le personnel du laboratoire doit être formé professionnellement. Le processus d'expérimentation doit être mené strictement dans différentes zones (zone de préparation des réactifs, zone de préparation des échantillons, zone d'amplification et d'analyse des produits). Tous les consommables doivent être jetables après stérilisation. Les appareils, équipements et fournitures spéciaux à chaque étape de l'opération expérimentale ne doivent pas être utilisés de manière croisée.
- Veuillez préparer l'enceinte de sécurité biologique pour l'étape de préparation des réactifs et des échantillons. La blouse de laboratoire, les gants jetables et la pipette doivent être effectués pendant l'expérience.
- La congélation et la décongélation répétées des réactifs doivent être évitées autant que possible. Avant utilisation, les réactifs doivent être complètement décongelés et centrifugés à 8 000 tr/min pendant plusieurs secondes.
- Veuillez placer la pipette utilisée dans la zone de préparation des échantillons dans le récipient contenant le désinfectant et la jeter avec les déchets après la stérilisation.
- Après l'expérience, la table de travail et le pipetteur ont été traités avec de l'hypochlorite à 10 % ou de l'alcool à 75 % ou une lampe ultraviolette.
(Fabrication)
Nom : Shandong Xinda Gene Technology
Une filiale de Shandong Sinder Technology
Adresse : Bâtiment B2, parc industriel de Bandaohuigu, route de Shungeng, ville de Zhucheng, province du Shandong
Shandong Sinder Technology («Sinder»), fondée en avril 1999, propose une large gamme de produits de santé animale. Sinder se concentre sur les produits de santé animale, les vaccins pour animaux, les anticorps, les antibiotiques, les additifs alimentaires, les produits à base de plantes chinoises, les aliments pour animaux de compagnie, Elisa et le kit de test PCR.
Sinder persiste toujours dans le concept de base de "La poursuite incessante de l'augmentation de la valeur client". ' Basé sur la santé animale pour atteindre un prestataire de services pour la construction écologique de l'agriculture et de l'élevage. Soutenir le développement efficace et durable de l'agriculture et de l'élevage. Rendre les aliments plus sûrs et les zones rurales meilleures !
Sinder est une entreprise de haute technologie et l'un des 10 principaux fabricants de médicaments vétérinaires en Chine et se concentre sur le secteur de la santé animale. À l'heure actuelle, la société compte 35 lignes de production GMP, 1 laboratoire CNAS, 3 plates-formes nationales de recherche scientifique et 8 plates-formes provinciales de recherche scientifique appartenant à Sinder.
Sinder possède 4 centres de R&D situés à Qingdao, Zhucheng et Pékin, en Chine, et 1 laboratoire dans la Silicon Valley aux États-Unis. À l'heure actuelle, la société compte 1 535 employés dont plus de 200 maîtres ou plus et 18 docteurs. En outre, la société a établi une vaste coopération technique avec plusieurs instituts de recherche scientifique nationaux et étrangers, des sociétés de santé animale et des entreprises nationales de médecine vétérinaire. Sinder a entrepris 57 projets nationaux, provinciaux et ministériels, remporté 7 prix provinciaux et ministériels de progrès scientifique et technologique, présidé ou participé à 23 normes nationales, obtenu 23 nouveaux certificats de médicaments vétérinaires (un nouveau médicament de 1ère classe) et 60 brevets autorisés.